Utilizzi
Un'applicazione tradizionale della
protezione catodica è quella per le superfici esterne di
tubazioni o cisterne in acciaio interrate o immerse in acqua di
mare.
Anche le superfici interne di
strutture quali scaldabagni e bollitori possono essere sottoposte a
protezione catodica.
Non è conveniente però applicare la
protezione catodica ad una struttura priva di rivestimento (es.
condotta in acciaio) perché l'installazione e l'esercizio
risulterebbe molto dispendiosa e comunque non si raggiungerebbe una
protezione efficace.
La sua applicazione diventa
conveniente quando il manufatto è dotato di una protezione passiva
(rivestimento dielettrico). In questo caso la protezione catodica (o
protezione attiva) completa la protezione alla corrosione
offerta dal rivestimento con costi limitati.
Cenni storici
 Anodo
sacrificale sullo scafo di una nave. Anodo
sacrificale sullo scafo di una nave.
La tecnica della protezione catodica
nasce ufficialmente in Inghilterra e fu inventata da sir Humphry
Davy nel 1824. Tale scoperta diede l'avvio al passaggio
definitivo dalle navi con scafo in legno a quelle con scafo in
metallo, altrimenti impensabile.
Un secolo dopo la sua invenzione tale
tecnica si afferma negli Stati Uniti e soltanto a partire dagli anni
'60 in tutto il mondo.
Le prime applicazioni in Italia
avvengono attorno al 1930 per la protezione delle guaine in piombo
dei cavi telefonici.
Meccanismo elettrochimico
Il terreno o l'acqua di mare per la
loro costituzione hanno un comportamento elettrolitico.
Pertanto un metallo interrato o immerso ha un comportamento analogo
a quello di un elettrodo immerso in una soluzione elettrolitica
(nella quale gli ioni fungono da portatori di carica).
Sulla superficie di metallo in contatto con l'elettrolita, ossia
all'interfase tra metallo ed elettrolita, possono esservi condizioni
di sviluppo di reazioni elettrochimiche.
Il processo di corrosione elettrochimica di un metallo (es. il
ferro) può avvenire solo se a contatto con il metallo sono presenti
ossigeno e acqua secondo la reazione:
- ferro + acqua + ossigeno =
prodotti di corrosione
Questa reazione e costituita da 4
processi parziali:
- Fe → Fe2+ + e 2-
- processo anodico (corrente Ia)
- O2 + 2H2O
+ 4e- → 4OH- - processo catodico (corrente
Ic)
- trasporto degli elettroni nel
metallo dalle regioni anodiche dove vengono resi disponibili a
quelle catodiche dove sono consumati (corrente Im)
- trasporto di ioni nell'elettrolita
(corrente Ie).
questi 4 processi sono complementari
cioè devono prodursi con la stessa velocità.
Il valore comune di queste correnti (Icorr=Ia=Ic=
Im=Ie) misura la velocità del processo globale
di corrosione.
La velocità di corrosione è quindi determinata dal più lento dei 4
processi parziali.
Il metallo può allora comportarsi di caso in caso come anodo o come
catodo (o talvolta anche avere entrambi i comportamenti in zone
diverse della sua superficie nel caso della corrosione
generalizzata, o nel caso della corrosione per aerazione
differenziale).
Principi di funzionamento
Nella protezione catodica, la
struttura metallica da proteggere non dovendosi comportare da anodo
viene resa più elettronegativa rispetto al potenziale di "libera
corrosione" che la stessa struttura assumerebbe nell'ambiente
elettrolitico in condizioni "naturali". Questo lo si ottiene
inviando, in senso contrario alla corrente di corrosione Icorr,
una corrente di protezione la cui intensità Ip ≥ Icorr;
pertanto la corrente risultante è nulla o diretta verso il metallo.
In pratica si immettono forzatamente elettroni nel metallo che si
corrode che vanno a compensare quelli persi durante il
processo di corrosione. Se questa condizione è verificata in tutti i
punti del manufatto a contatto con l'ambiente esterno il fenomeno
della corrosione si arresta poiché in queste condizioni il metallo
si comporta come un catodo, questo sistema di difesa si chiama
protezione catodica.
Tipologia
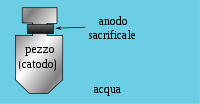 Protezione
catodica con anodo sacrificale Protezione
catodica con anodo sacrificale
La protezione catodica può essere
attuata con :
accoppiamento galvanico (o ad anodo sacrificale): il metallo da
proteggere (che deve assumere la funzione di catodo) è collegato ad
un metallo di tipo diverso e più elettronegativo che funga
spontaneamente da anodo sacrificale (seguendo questa tecnica,
il ferro da proteggere deve essere collegato con l'alluminio,
lo zinco
o il
magnesio). L'anodo sacrificale è destinato al progressivo
consumo nel tempo e può essere necessaria la sua sostituzione
periodica. Un utilizzo classico è quello sullo scafo metallico delle
navi.
Immagini e testi da
Wikipedia |